Por: Dra. Mariana dos Santos Lopes Leão
Doutora em Higiene Veterinária e Processamento Tecnológico de Produtos de Origem Animal, Mestre em Microbiologia e Parasitologia Aplicadas e Bióloga.
A desinfecção de ambientes controlados é uma prática comum na área de saúde e produção de alimentos, bebidas e até mesmo cosméticos. Independente do mecanismo, os biocidas desempenham importante papel na limitação de fontes potenciais de infecção e ainda parecem ser efetivos, porém o aumento do uso de biocidas na comunidade vem acarretando o desenvolvimento da resistência, assim como o potencial para resistência cruzada a antibióticos de uso clínico. Sendo através de projeção genética ou pela produção de biofilme, o fato é que conhecer os mecanismos de resistência é um fator decisivo para o sucesso de desinfecções.
Durante as últimas décadas, houve considerável aumento de ocorrências de bactérias multirresistentes, consequentemente, houve aumento no uso de desinfetantes e anti-sépticos, com diferentes metodologias e combinações. Entre as bactérias, algumas são comumente encontradas em ambientes que nessecitam de controles, como Staphylococcus aureus, Streptococcus epidermidis, Escherichia coli, Klebsiella pneumoniae, Enterobacter sp, Serratia marcescens, Pseudomonas aeruginosa, Acinetobacter baumannii e Stenotrophomonas maltophilia (LEVY, 2000).
Biocidas e seu Mecanismo de Ação
Biocida pode ser definido como qualquer substância que contém um ou mais agentes ativos, capaz de prevenir, inibir, diminuir ou eliminar a ação de organismos vivos patogênicos e não patogênicos (definição adaptada da European Commission, 1998). São importantes para alcançar níveis apropriados de desinfecção de superfícies e materiais. Em contraste com os agentes quimioterápicos, biocidas têm múltiplos alvos na célula microbiana, e os danos causados resultam no efeito bactericida (MAILLARD, 2002). No entanto, os biocidas podem interagir com a parede celular ou com o envelope (glutaraldeído), produzir mudanças na integridade da membrana citoplasmática (agentes catiônicos), dissipar força próton-motora (ácidos orgânicos e ésteres), inibir enzimas de membrana (substâncias que interagem com grupos de tiol) quelante (óxido etileno) e interquelante (acridina) (DENYER e STEWART, 1998). A atividade dos biocidas varia grandemente entre os diferentes tipos de microrganismos. Entre as bactérias vegetativas, as micobactérias são provavelmente as mais resistentes à desinfecção, seguidas pelas Gram-negativas e Gram-positivas (MAILLARD, 2002). Essa classificação baseia-se na diferença de permeabilidade, ou não, dos microrganismos ao agente ativo (DENYER e MAILLARD, 2002). Em relação à suscetibilidade a biocidas, a estrutura e a composição do envelope externo diferem entre microrganismos. A membrana externa de bactérias Gram-negativas (GILBERT et al., 1990) atuam na permeabilidade e são responsáveis pela resistência intrínseca desses microrganismos a componentes antimicrobianos (MAILLARD, 2002). A membrana citoplasmática é considerada o principal alvo dos biocidas. Um dos efeitos da interação dos biocidas com a célula bacteriana é a mudança na hidrofobicidade celular. Por exemplo, foi observado que a hidrofobicidade de bactérias Gram-negativas altera quando estas são tratadas com compostos catiônicos, como clorhexidina (FITZGERALD et al., 1992). O objetivo dos desinfetantes está além da eliminação de patógenos, são importantes na manutenção dos filtros mais limpos, remoção do ferro e manganês, destruição do sulfeto de hidrogênio, diminuição da cor, gosto e odor e ainda são fortemente atuantes na oxidação da amônia, na proteção de membranas filtrantes e controle de algas no pré-tratamento.
Resistência Microbiológica à Biocidas
Quando ocorre, a resistência tipicamente resulta de mudanças celulares que levam ao acúmulo de biocidas, incluindo alterações no envelope celular que limitam o transporte, ou expressão de sistemas de efluxo. Mutações do sítio-alvo, embora raras, são relatadas (POOLE, 2002). Outro mecanismo de resistência bacteriana é o sistema efluxo, que consiste na ação protéica transmembrana plasmática com capacidade de transportar moléculas para o exterior das células, como por exemplo, moléculas de biocidas. De acordo com PAULSEN et al. (1996), P. aeruginosa possui sistema de efluxo que expulsa drogas com potencial para danificar a célula. A presença de resistência a multidrogas, que conferem resistência a antibióticos, anti-sépticos, desinfetantes e conservantes, é bem documentada em S. aureus (LITTLEJOHN et al., 1992; PAULSEN et al., 1996; HEIR et al., 1999;
MUNOZBELLIDO et al., 1999). Maior atenção é dada aos sistemas de efluxo em bactérias Gram- negativas, mas esses parecem conferir resistência mais a antibióticos que a biocidas (POOLE et al., 1993; PAULSEN et al., 1996; MASUDA et al., 1999; ZIHA-ZARIFI et al., 1999).
Assim como o sistema de efluxo em S. aureus possui uma gama de substratos, é possível também que pelo menos um dos vários sistemas conhecidos de P. aeruginosa possa conferir-lhe resistência simultânea a biocidas e a antibióticos (THOMAS et al., 2000). Klebsiella pneumoniae também utiliza algumas proteínas, cujos genes estão localizados em plasmídeos, que executam o sistema efluxo, exportando biocidas (LEELAPORN et al., 1994; PAULSEN et al., 1996; CHUANCHUEN et al., 2001). O desenvolvimento da resistência a desinfetantes e conservantes não é um fenômeno novo. Em 1952, CHAPLIN isolou linhagens resistentes a compostos quaternários de amônio (in CHAPMAN, 1998).
Resistência Microbiológica através de Biofilme
O biofilme é uma comunidade bacteriana séssil, ligada a um substrato e incorporada a uma matriz extracelular. É considerado um problema a saúde, devido seu potencial para atuar como fonte de contaminação da água, em consequência da resistência aos sanificantes. Em suma, as bactérias podem aderir a superfícies sólidas e formar uma camada viscosa, caracterizando assim, os biofilmes (COSTERTON et al., 1999). A adesão se torna irreversível quando estes microrganismos iniciam a produção de polímeros extracelulares (DONLAN, 2001), responsável por proteger a maioria das bactérias da opsonização e fagocitose, tornando-as difíceis de desalojar (STEPHENS, 2002). Estudos realizados por GUTIÉRREZ et al., 2012; ABUSHELAIBI et al.,
2012, demonstram a resistência das células
aderidas em relação a desinfetantes, perante a dificuldade da eliminação de biofilmes em superfícies e a necessidade de um processo de higienização adequado (CAIXETA et al., 2010). As bactérias livres no meio circundante, podem aderir a superfícies sólidas e formar uma matriz extracelular, caracterizando assim, os biofilmes ou células aderidas (COSTERTON et al., 1999). Este termo tem sido utilizado para descrever a população de células microbianas inserida em uma matriz polimérica extracelular (EPS) (LAZAR, 2011), constituída, principalmente, por proteínas e polissacarídeos (SIMÕES et al., 2010; JAHN e NIELSEN, 1998; WINGENDER et
al., 1999). Essas comunidades microbianas são de suma importância para a sobrevivência e persistência de bactérias em ambientes inóspitos (JOHNSON, 2008). Devido a estas características, e sob condições ambientais adequadas (presença de material orgânico, pH e temperatura), todos os microrganismos (geralmente são formados por duas ou mais bactérias) podem formar biofilme (LASA et al., 2005), tanto em ambientes bióticos quanto abióticos (BOARI et al., 2009). De forma geral, inicialmente, ocorrem interações entre a bactéria e a superfície do material impulsionado por forças, como hidrofóbicas, eletrostáticas e Van der Waals. Na segunda fase, o biofilme é estabelecido na superfície através de reações moleculares e apenas na etapa subsequente que a maturação ocorre e as características estruturais do biofilme são desenvolvidas. Na quarta e última etapa, as células no biofilme retornam para vida planctônica como novos colonizadores iniciando novos ciclos de contaminação (ARCIOLA et al., 2012; SIMÕES et al., 2010) (Fig. 3). A resistência de microrganismos patogênicos está atribuído, frequentemente, ao uso inadequado ou em excesso de antibióticos e a transmissão de genes de resistência entre os indivíduos em biofilme (BORGES et al., 2013) através do quorum sensing (regulação da expressão gênica em resposta a flutuações na densidade da população celular. As bactérias sensoras de quorum produzem e liberam moléculas de sinalização química chamadas autoindutores, que aumentam de concentração em função da densidade celular). Além disso, o EPS (Exopolissacarídeo ou Matriz Polimérica Extracelular) serve de barreira, e impede que o agente tóxico chegue às camadas mais profundas do biofilme (KRÓLASIK et al., 2010) além de conferir proteção contra radiações ultravioletas (UV), alterações de pH, choques osmóticos e dessecação (BOARI et al., 2009). Células associadas em biofilme são mais resistentes a antibióticos, detergentes e cloro (WATNICK e KOLTER, 2000).

Figura 3: Microscopia eletrônica de varredura (MEV) da formação de biofilme por Pseudomonas aeruginosa. (A) Agregação de cultura estacionária de 48 horas de idade; (B) Biofilme de 3 dias de idade; (C) Detalhes do agregado bacteriano de 48 horas de idade; (D) Células planctônicas (BJARNSHOLT, 2013).
Marques et al. (2007) ao avaliarem a eficiência de sanificantes químicos, na remoção de biofilmes de S. aureus, observaram que nenhum deles removeu completamente as células aderidas nas superfícies de aço inoxidável e vidro, apenas houve redução na multiplicação microbiana. Da mesma forma, em estudos realizados por Simões et al. (2008), tanto os biofilmes de Bacillus cereus quanto de Pseudomonas fluorescens foram resistentes ao antimicrobianos testados, evidenciando assim, que microrganismos em biofilme estão mais protegidos aos agentes antimicrobianos e a fatores externos. A resistência intrínseca dos biofilmes a biocidas é claramente demonstrada em diversos estudos realizados, como os efetuados com células não aderidas de Listeria monocytogenes, em que as mesmas foram eliminadas após 30 segundos de contato com o sanitizante cloreto de benzalcônio, enquanto as células aderidas resistiram ao mesmo sanitizante por 20 minutos (Frank e Kofi, 1990). Outros microrganismos, como P. fluorescens e Yersinia enterocolitica, quando na presença de hipoclorito de sódio, sofreram cinco reduções decimais quando em suspensão, mas as celulas aderidas alcançaram valores máximos de 3,2 reduções decimais (Mosteller e Bishop, 1993). RECH, 2013 evidenciou resistência de diferentes cepas de E. coli ao hipoclorito de sódio, inclusive quando em formação de biofilme.
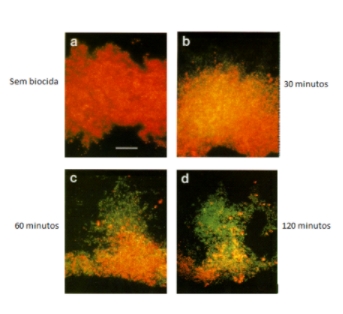
Figura 4: Efeito de biocida sobre biofilmes (Huang et al., 1995)
Referências:
ABUSHELAIBI, Aisha A.; AL SHAMSI, Mariam S.; AFIFI,
Hanan S. Use of antimicrobial agents in food processing systems. Food Nutr. Agric., v. 4, p. 2-7, 2012.
ARCIOLA, Carla R. et al. Biofilm formation in Staphylococcus implant infections A review of molecular mechanisms and implications for biofilmresistant materials. Biomaterials, v. 33, p. 5967-5982, 2012.
BJARNSHOLT, T. The role of bacterial biofilms in chronic infections. APMIS, v.121, suppl.136, p.1-54, 2013.
BOARI, Cleube A. et al. Formação de biofilme em aço inoxidável por Aeromonas hydrophila e Staphylococcus aureus usando leite e diferentes condições de cultivo. Ciênc. Tecnol. Aliment., v. 29, n. 4, 2009.
BORGES, Anabela. et al. Antibacterial Activity and Mode of Action of Ferulic and Gallic Acids Against Pathogenic Bacteria. Microb. Drug Resist., 2013.
CAIXETA, Daniela S. et al. Chemical sanitizers to control biofilms formed by two Pseudomonas species on stainless steel surface. Ciência e Tecnologia de Alimentos, v. 32, n. 1, p. 142-150, 2010.
CHAPMAN, J.S. Characterizing bacterial resistance to preservative and disinfectants. International Biodeterioration & Biodegradation, v. 41, p. 241-245, 1998.
COSTERTON, J. W.; STEWART, Philip S.;
GREENBERG, E. P. Bacterial Biofilms: A Common Cause of Persistent Infections. Science, v. 284, mai., 1999.
DENYER, S.P. STEWART, G.S.A.B. Mechanisms of
action of disinfectants. International Biodeterioration & Biodegradation, v. 41, p. 261-268, 1998.
DENYER, S.P., MAILLARD, J.Y. Cellular impermeability and uptake of biocides and antibiotic in Gram-negative bacteria. Journal of Applied Microbiology, p. 35-45, 2002 (suppl., 92).
DONLAN, Rodney M. Biofilms and Device-Associated Infections. Emerg. Infect. Dis., v. 7, n. 2, mar.-abr., 2001.
FITZGERALD, K.A., DAVIES, A., RUSSELL, A.D. Effect
to clorhexidine and phenoxyethanol on cell surface hydrophobicity of Gram-positive and Gramnegative bacteria. Letters in Applied Microbiology, v. 14, p. 91-95, 1992.
Frank, J. H.; Kofi, R. A surface-adherent growth of Listeria monocytogenes is associated with increased resistance to surfactant sanitizers and heat. Journal of Food Protection. v. 53, nº 7, 550-554. 1990.
GILBERT, P., PEMBERTON, D., WILKINSON, D.E.
Barrier properties of the Gram-negative cell envelope towards high molecular weight polyhexamethylene biguanides. Journal of Applied Bacteriology, v. 69, p. 585-592, 1990.
GUTIÉRREZ, Diana. et al. Incidence of Staphylococcus aureus and analysis of associated bacterial communities on food industry surfaces. Applied Environmental Microbiology, v. 78, n. 24, 2012.
HEIR, E., SUNDHEIM, G., HOLCK, A.C. The qacG gene
on plasmid pST94 confers resistance to quaternary ammonium compounds in staphylococci isolated from the food industry. Journal of Applied Microbiology, v. 86, p. 378-388, 1999.
CHING-TSAN HUANG, C., PHILIP, Y. F., MCFETERS,
- A., STEWART, H. S. Nonuniform Spatial Patterns of Respiratory Activitywithin Biofilms during Disinfection. APPLIED AND ENVIRONMENTAL MICROBIOLOGY, V 61, no. 6, p. 2252–2256, 1995.
CHING-TSAN HUANG, F. PHILIP YU, GORDON A.
MCFETERS, PHILIP S. STEWART. Nonuniform Spatial Patterns of Respiratory Activitywithin Biolms during Disinfection. APPLIED AND Environmental Microbiology,V. 61, n. 6, p. 2252–2256, 1995.
JAHN, A.; NIELSEN, P. H. Cell biomass and exopolymer composition in sewer biofilms. Water Science and Technology, 37, 17–24. 1998.
JOHNSON, Leah R. Microcolony and biofilm formation as a survival strategy for bacteria. Journal of Theoretical Biology, v. 25, n. 1, p. 24-34, 2008.
KRÓLASIK, Joanna. et al. Resistance of bacterial biofilms formed on stainless steel surface to disinfecting agent. Pol. J. Microbiol., v. 59, n. 4, p. 281-287, 2010.
LASA, I. et al. Biofilms bacterianos e infección. An. Sist. Sanit. Navar., v. 28, n. 2, p. 163-175, 2005.
LAZAR, Veronica. Quorum sensing in biofilms – How to destroy the bacterial citadels or their cohesion/Power? Anaerobe, v. 17, p. 280-285, 2011.
LEELAPORN, A., PAULSEN, I.T., TENNENT, J.M., LITTLEJOHN, T. G., SKURRAY, R.A. Multidrug
resistance to antiseptics and disinfectants in coagulase- negative staphylococci. Journal of Medical Microbiology. v. 40, p. 214-220, 1994.
LEVY, S.B. Antibiotic and antiseptic resistance: impact on public health. Pediatric Infectious Disease Journal, p.120-122, 2000 (suppl., 19).
LITTLEJOHN, T.G., PAULSEN, I.T. GILLESPIE, M.T. et
- Substrate specificity and energetic of antiseptic and disinfectant resistance in Staphylococcus aureus. FEMS Microbiology Letters, v. 95, p. 259-266, 1992.
MAILLARD, J.Y. Bacterial target sites for biocide action. Journal of Applied microbiology, p. 16-27, 2002. (suppl., 92).
MARQUES, Simone C. et al. Formation of biofilms by Staphylococcus aureus on stainsless steel and glass surfaces and its resistance to some selected chemical sanitizers. Brazilian Journal of Microbiology, v. 38, p. 538-543, 2007.
MASUDA, N., GOTOH, N., ISHII, C., SAKAGAWA, E.,
OHYA, S., NISHINO, T. Interplay between chromosomal β-lactamase and the MexAB-oprM efflux system in intrinsic resistance to β-lactams in Pseudomonas aeruginosa. Antimicrobial Agents and Chemotherapy, v. 43, p. 400-402, 1999.
MOSTELLER, T. M.; Bishop, J. R. Sanitizer efficacy against attached bacteria in a milk biofilm. Journal of Food Protection. v. 56, nº 1, 34-41, 1993.
MUNOZ-BELLIDO, J.L., ALONSO MANZANARES, M.A.,
MARTINEZ ANDRÉS, J.A., et al. Efflux pump-mediated quinolone resistance in Staphylococcus aureus strains wild type for gyrA, gyrB, grlA and norA. Antimicrobial Agents and Chemotherapy, v. 43, p. 354-356, 1999.
PAULSEN, I.T., BROWN, M.H., SKURRAY, R.A. Proton-
dependent multidrug efflux systems. Review Microbiology, v. 60, p. 575-608, 1996.
POOLE, K., KREBES, K., McNALLY, C., NESHAT, S.
Multiple antibiotic resistance in Pseudomonas aeruginosa: Evidence for involvement of efflux operon. Journal of Microbiology, v. 175, p. 7363-7372, 1993.
POOLE, K. Mechanisms of bacterial biocide and antibiotic resistence. Journal of Applied Microbiology, p. 55-64, 2002 (suppl., 92).
RECH, C. R. Estudo da adesão e formação de biofilme de Escherichia coli em PET poli (tereftalato de etileno) e resistência a biocidas. Dissertação de mestrado em ciência e tecnologia ambiental. UFGD. 72p. 2013
SIMÕES, Manuel. et al. The effects of a biocide and a surfactant on the detachment of Pseudomonas fluorescens from glass surfaces. Int. J. Food Microbiol., v. 121, p. 335-341, 2008.
SIMÕES, Manuel.; SIMÕES, Lúcia C.; VIEIRA, Maria J. A
review of current and emergente biofilm control strategies. Food Science and Technology, v. 43, p. 573- 583, 2010.
STEPHENS, Craig. Microbiology: Breaking Down Biofilms. Current Biology, v. 12, p. 132-134, 2002.
THOMAS, L., MAILLARD, J.Y., LAMBERT, R.J.W.,
RUSSELL, A.D. Development of resistance to clorhexidine diacetate in Pseudomonas aeruginosa and the effect of “residual” concentration. Journal of Hospital Infection, v. 46, p. 297-303, 2000.
WATNICK, Paula; KOLTER, Roberto. Biofilm, City or Microbes. J. Bacteriol., v. 183, n. 10, p. 2675-2679, 2000.
WINGENDER, J.; NEU, T. R.; FLEMMING, H.C. What
are bacterial extracellular polymeric substances?. Microbial extracellular polymeric, p. 1-19, 1999.
ZIHA-ZARIFI, I., LLANES, C., KOHLER, T., PECHERE,
J.C., PLESIAT, P. In vivo emergence of multidrug- resistance mutants of Pseudomonas aeruginosa overexpressing the active efflux system MexAB-MexB- oprM. Antimicrobial Agents and Chemotherapy, v. 43, p. 287-291, 1999.